《药品管理法实施条例》(“《条例》”)是《药品管理法》的重要配套行政法规。现行《条例》于2002年公布施行,主要内容包括药品生产企业管理、药品经营企业管理、医疗机构的药剂管理、药品管理、药品包装的管理、药品价格和广告的管理、药品监督和法律责任等。现行《条例》自公布以来,曾于2016年、2019年、2024年进行过三次局部技术性调整。
2026年1月16日,国务院总理李强签署国务院令,公布修订后的《中华人民共和国药品管理法实施条例》(“新《条例》”)。新《条例》共9章89条(主要章节包括:总则、药品研制和注册、药品上市许可持有人、药品生产、药品经营、医疗机构药事管理、监督管理、法律责任、附则),将自2026年5月15日起施行,本次公布的新《条例》距离上次修改时间间隔仅13个月,但不同于此前对现行《条例》的局部技术性调整,新《条例》是二十三年来首次全面修订,修改的条款达到90%以上[1]。
2015年8月9日,《国务院关于改革药品医疗器械审评审批制度的意见》首次提出开展药品上市许可持有人制度试点;2019年8月26日,《药品管理法》修订,其中第六条明确规定“国家对药品管理实行药品上市许可持有人制度”,自此,我国正式在法律层面引入药品上市许可持有人制度。近年来,国家持续鼓励药品创新,国家药监局不断优化创新药审评审批流程,2025年我国获批上市创新药达76个,大幅超过2024年全年48个,创下历史新高[2]。可见,如今我国的医药监管环境及行业需求与二十多年前相比已发生巨大变化,法律法规制度也需要顺应时代的发展,不断修订完善。在此背景下,新《条例》深度呼应并细化了2019年修订的《药品管理法》中的制度措施,将药品上市许可持有人制度、全生命周期监管理念及近年来药品监管改革中成熟的经验上升为法规层面[3]。新《条例》对监管要求的改革与修订,有助于进一步促进我国药品创新的蓬勃发展。
本文将聚焦新《条例》的部分修订亮点。
一、药品研制与注册制度新《条例》第二章“药品研制和注册”(第六条至第二十二条)明确了对药品的研发、审评、准入等环节的有关要求,其中不乏引人关注的制度创新举措。
1. 临床试验申办者变更机制新《条例》发布以前,《药品注册管理办法》仅在第二十九条规定,申办者发生变更的,由变更后的申办者承担药物临床试验的相关责任和义务,而未对具体的变更程序等作出规范。
本次新《条例》的修订,在第九条进一步明确临床试验申办者变更的相关流程,药物临床试验变更申办者的,应当向国务院药品监督管理部门提出申请,国务院药品监督管理部门应当自受理申请之日起20个工作日内进行审查并作出决定。
在当前医药BD交易活跃的背景下,很多药企之间可能会选择进行合作开展临床试验或由被许可方作为申办者开展临床试验,而药物研发往往具有很大的不确定性,在许可交易中,可能因数据结果不理想、研发受阻、管线间竞争、资源不足等原因导致合作终止。根据媒体数据统计,截至2025年,在2020年已完成的62起BD交易中,已有25起终止合作,“终止率”为40%,而2021年和2022年的“终止率”也有20%左右[4]。
在BD交易终止后,如果标的药品正好处在临床试验阶段,如何处理正在进行的临床试验?除了可以在协议中约定,在考虑患者安全事项的情况下,依法依规地终止、退出该等临床试验,也可以依据新《条例》的规定,相应变更临床试验申办者,由许可方继续相关的临床试验。因此,新《条例》对变更临床试验申办者程序的进一步明确,为创新药研发过程中的权益转让、BD交易退出机制提供了更多路径选择。
但是,对于变更临床试验申办者的程序,还有许多具体的问题需要明确,例如由哪一方负责提出申请、依照什么程序申请、需要哪些资料、责任何时转移等。这些问题需要后续更多的法规、规章、指导原则等文件进行细化,也建议相关企业依照新《条例》第九条变更临床试验申办者时,积极与监管部门沟通详细的程序和相关问题。
2. 境外数据认可机制新《条例》第十条规定,以申请药品注册为目的在境外开展药品研制活动的,应当遵守药品管理法、本条例等法律、法规、规章、标准和规范的有关规定;在境外取得的研究数据,符合国务院药品监督管理部门有关规定的,可以用于申请药品注册。
本条规定有利于需要进行国际多中心临床试验的企业。国际多中心临床试验(International Multi-Center Clinical Trial, IMCT),是指在多个国家或地区的多个研究中心,按照同一临床试验方案同步开展的药物临床试验。对于药企来讲,具有同步收集多国数据,避免重复试验,缩短研发周期等显著优势。
因此,生物制药企业在全球开展国际多中心临床试验,如果研制活动、研制数据符合中国法律法规及国家药监局的有关规定,原则上可以实现一份试验数据同时用于药品在中国及其他国家的同步上市注册,例如同时提交中国国家药监局、FDA、EMA等多个监管机构。境外数据认可机制将激励跨国药企将中国纳入全球早期研发与申报体系,推动创新药在境内外同步获批,加快药品的上市速度,推动全球创新药物在中国早日上市。
但是需要提醒企业的是,开展国际多中心临床试验,需要同时考虑各个目的国对于研发活动、数据等领域的法律法规与技术标准,企业需要厘清各国之间数据跨境传输、数据与生物安全、人类遗传资源等多方面的法律法规,严守合规底线。
3. 对药品创新的支持政策此前,国家已经在政策层面与技术指导文件中多次提出支持创新,本次新《条例》的修订不仅将“国家完善药品创新体系,支持以临床价值为导向的药品研制和创新,鼓励研究和创制新药,支持新药临床推广和使用”、“促进中药传承创新”和“促进仿制药研发创新,提升仿制药质量和疗效”等原则明确写进了总则部分的第三条,同时详细配套了多项具有确定性和可预期性的措施,再次为担忧政策落地确定性的创新企业提供了制度保障。
(1)对审评体系进行法制化升级,明确优化药品注册审评审批流程
在制度设计方面,新《条例》明确规定了符合条件的药品适用上市快速审评通道。新《条例》第十五条明确“国务院药品监督管理部门可以对符合条件的药品注册申请采用突破性治疗药物程序、附条件批准程序、优先审评审批程序、特别审批程序等,加快药品上市”。新《条例》第十五条的落地将上述多条药品加速上市通道从2020年《药品注册管理办法》的部门规章层级正式提升至行政法规的层级,旨在支持以临床价值为导向的药品研制和创新。
对于新《条例》中所提到“符合条件的药品注册申请”所指代的具体要求,还需进一步参考《药品注册管理办法》中的有关规定。值得注意的是,在纳入快速审评程序后,如果发现拟上市的药物不再符合纳入条件的应当终止该品种优先审评审批程序,按照正常审评程序审评。结合《药品注册管理办法》,我们将新《条例》第十五条中提到的各个快速审评程序的有关纳入条件及政策支持总结如下:
(a)突破性治疗药物程序
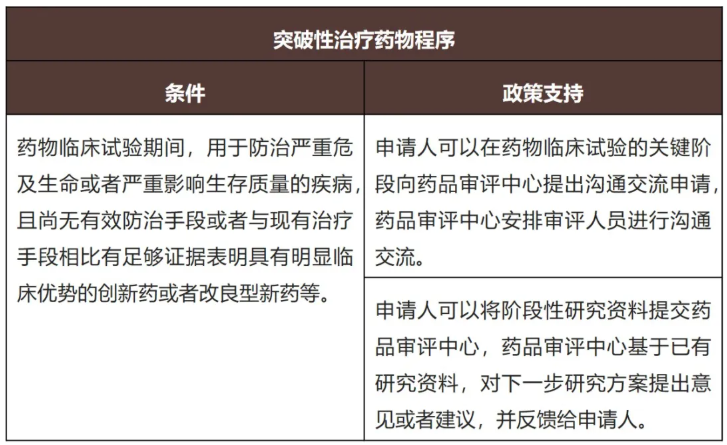
(b)附条件批准程序
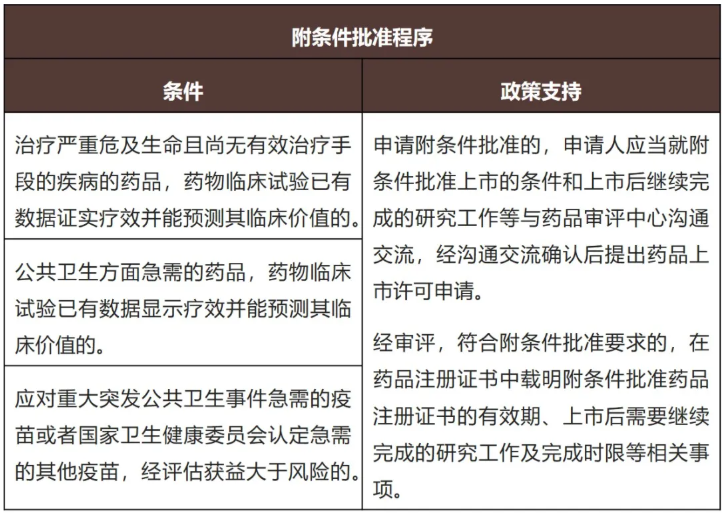
(c)优先审评审批程

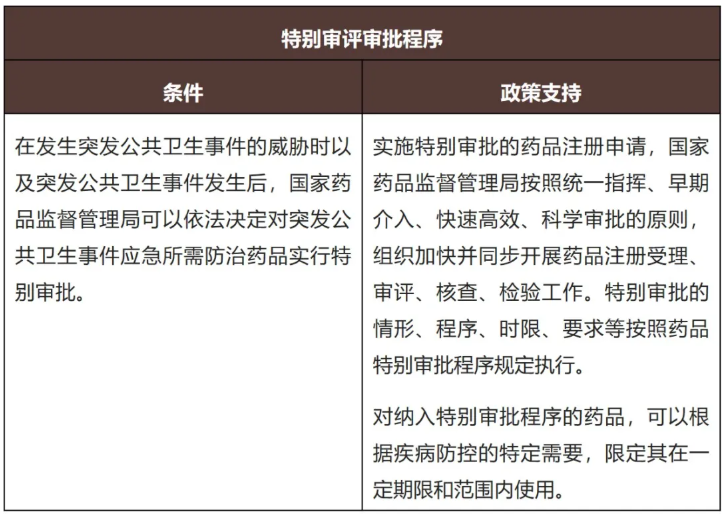
(d)特别审批程序
(2)市场独占期制度
新《条例》第二十一条明确了国家支持儿童用药品、罕见病治疗用药品的研制和创新,通过对符合条件的药品给予一定时间的市场独占期来激励相关药品的研发与供应,我们将具体的适用类型和市场独占期期限总结如下:
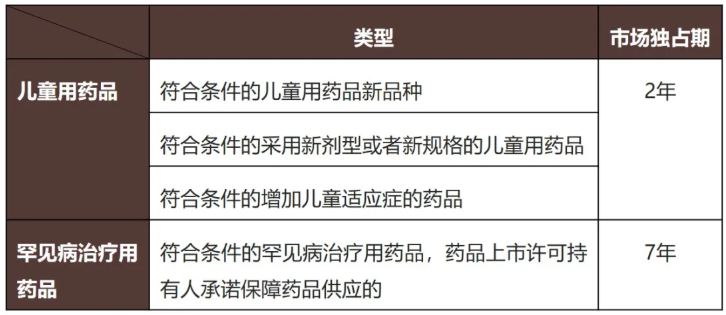
市场独占期制度在国际上,如美国、欧洲等地区,已有多年的实践基础,通过给予特定药品一定期限的排他性权利,激励企业在某些高投入、高难度的特定领域进行研发活动,以达到保障药品供应的效果。
2024年12月30日,国务院办公厅在《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》第二条第四款中提出要“对符合条件的罕见病用药品、儿童用药品、首个化学仿制药及独家中药品种给予一定的市场独占期”。
本次《条例》修订首次落实了相关政策,将市场独占期制度提升至法规层面,并明确了相关的保护期限,并将市场独占期制度特别聚焦于儿童用药和罕见病治疗药物。之所以对这两类药品实施精准干预,是因为它们普遍存在研发难度大、投入成本高、适用人群少、商业回报有限等现实困境,导致部分患儿和罕见病患者长期面临“无药可研、无药可用”的严峻局面[5]。
新《条例》在授予市场独占期的同时,也设定了严格的约束条件,其在第二十一条中规定:“药品上市许可持有人不履行保障药品供应承诺的,市场独占期终止。”因此,上述相关企业在享受政策激励与制度倾斜的同时应当积极履行其应承担的义务。
虽然新《条例》的修订首次将市场独占期制度及相关期限落实至法规层面,但新《条例》第二十一条也明确提到“给予市场独占期的具体条件和办法,由国务院药品监督管理部门制定”,因此,后续还会有更多详细的配套制度出台,建议希望利用市场独占期制度的相关企业持续关注后续配套法规、指导文件。
(3)完善试验数据保护制度
新《条例》第二十二条延续了现行《条例》中对于创新药品的数据保护制度,该制度的核心在于,对药品上市许可持有人自行取得且尚未公开的试验数据及其他相关数据给予法律保护,从而鼓励创新。试验数据保护制度是对专利保护体系的重要补充,二者结合将进一步促进创新企业的研发与投入。新《条例》在延续并完善试验数据保护制度的同时扩展了其适用范围,相关的新旧法规对比如下:

新《条例》中对数据保护制度的适用范围,从“含有新型化学成份药品”扩展至“含有新型化学成份的药品以及符合条件的其他药品”,其中“符合条件的其他药品”作为一种兜底情况为制度未来的适用留下了更多灵活性,以应对药品的创新和监管需求,例如,基于该种兜底情况细胞治疗与生物制品等其他药品也可能适用数据保护制度。
值得注意的是,新《条例》第二十二条也指出:“本条第一款规定的数据的具体保护办法,由国务院药品监督管理部门制定。”这意味着数据保护期的具体操作规则可参考后续监管部门出台的配套规章、实施细则及指导性文件。因此,相关企业需持续关注药监部门的政策动态,以便及时调整研发与注册策略。
二、对上市许可持有人新《条例》第三章“药品上市许可持有人”(第二十三条至第二十九条)对上市许可持有人全周期的义务与责任作出了系统性的规范,本部分内容也是新《条例》将监管重心从"管生产、销售企业"转向"管品种、管全链条"的重要体现,呼应了2019年《药品管理法》的修订,通过细化上市许可持有人的责任,落实其作为药品安全第一责任人的法律地位。
1. 全生命周期管理新《条例》细化药品上市许可持有人的责任。要求药品上市许可持有人建立健全药品质量保证体系、药物警戒体系,全面评估药品生产过程中的变更对药品质量的影响,定期对药品开展上市后评价。
目前,根据《药品管理法》、新《条例》等相关法律法规的规定,药品上市许可持有人对药品研制、生产、经营、使用全过程中药品的安全性、有效性和质量可控性负责,应当对药品的非临床研究、临床试验、生产经营、上市后研究、不良反应监测及报告与处理等承担责任。上市许可持有人需要履行的义务包括但不限于以下方面:
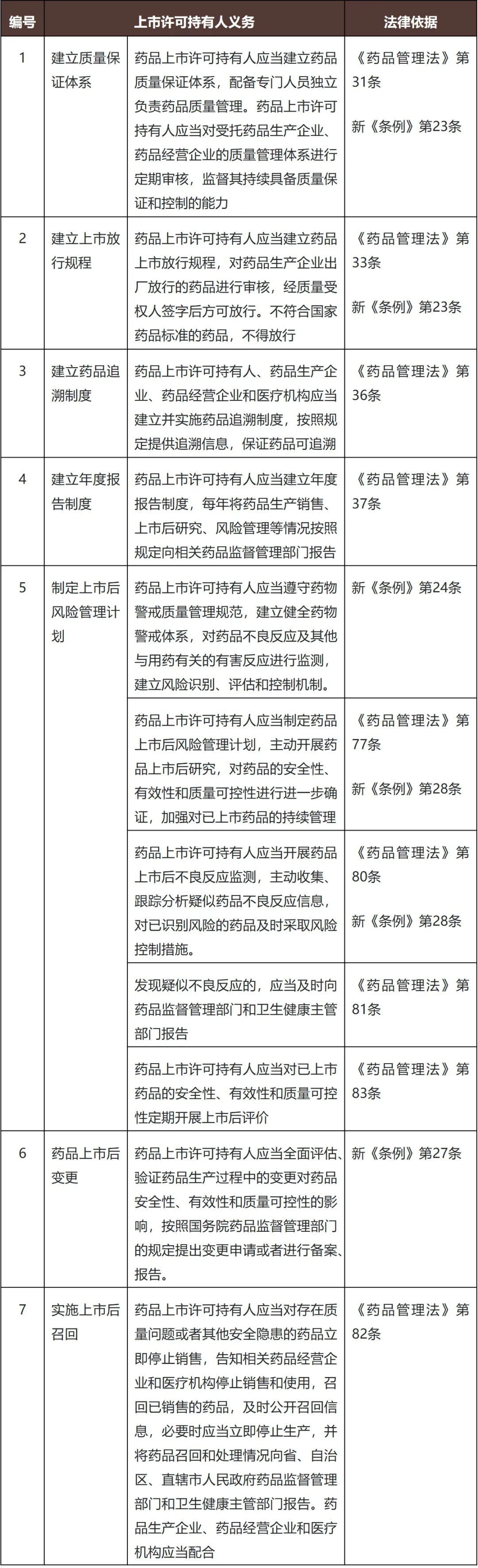
此外,值得注意的是,新《条例》第二十八条将药品上市后评价的义务履行与药品再注册机制链接,明确药品上市许可持有人未按照规定持续考察已注册药品质量、疗效和不良反应,或者未按照国务院药品监督管理部门要求开展上市后评价的,药品注册证书有效期届满后不予再注册。这一点与《药品注册管理办法》第八十四条相呼应,警示药品上市许可持有人应当持续履行上市后管理、药物警戒、上市后评价等义务,否则可能影响药品的再注册资格。除了新《条例》第二十八条提到的情形外,药品在以下情形下也将不予再注册:
- 有效期届满未提出再注册申请的;
- 未在规定时限内完成药品批准证明文件和药品监督管理部门要求的研究工作且无合理理由的;
- 经上市后评价,属于疗效不确切、不良反应大或者因其他原因危害人体健康的;
- 法律、行政法规规定的其他不予再注册情形。
新《条例》第二十六条规定药品上市许可持有人应当提供语音、大字、盲文或电子等无障碍格式版本的药品标签、说明书。这一规定不仅方便了对说明书的查询,也回应了残疾人、老年人等特殊群体的用药需求,体现了药品监管的人文关怀,呼应了《中华人民共和国无障碍环境建设法》第三十七条“国务院有关部门应当完善药品标签、说明书的管理规范,要求药品生产经营者提供语音、大字、盲文、电子等无障碍格式版本的标签、说明书”的要求。
此外,该条进一步细化相关要求电子版本药品说明书内容应当与国务院药品监督管理部门核准的药品说明书内容一致,与纸质版本药品说明书具有同等效力,而语音、盲文版本药品标签、说明书作为参考。
三、药品生产企业新《条例》第四章“药品生产”(第三十条至第四十一条)对药品生产企业的责任作出了规范,该部分内容适应生物药等创新品种的生产特点,在严格监管前提下引入分段生产等柔性机制,同时强化中药生产规范管理。
1. 分段委托生产的突破性规定2024年10月21日,国家药监局基于我国生物医药产业发展现状和监管实际等目标,发布并实施了《生物制品分段生产试点工作方案》,允许创新生物制品、临床急需生物制品等药品开展分段生产的试点工作,品种包括多联多价疫苗、抗体类生物制品、抗体偶联类生物制品、胰高血糖素样肽-1类生物制品以及胰岛素类生物制品等。自试点以来,药监部门已在广东、江苏、上海、北京、天津等多个省市开展了相关的试点工作并总结了经验,本次新《条例》的修订将试点经验法制化。
新《条例》第三十二条在法规层面正式确立了分段生产制度,明确药品上市许可持有人确有需要的,可以委托符合条件的药品生产企业分段生产(1)生产工艺、设施设备有特殊要求的创新药;(2)临床急需的药品、应对突发公共卫生事件急需的药品或储备需要的药品;(3)国务院药监部门规定的其他药品。
疫苗不同于一般药品,有着更严格的分段生产适用条件。根据新《条例》第三十三条,疫苗上市许可持有人分段委托生产,需同时满足以下条件:
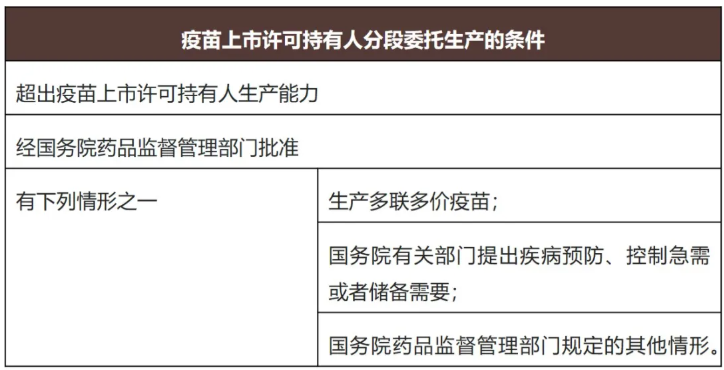
传统的委托生产原则上要求药品的所有工序在同一生产场地完成,上市许可持有人通常将完整生产流程委托给单一受托方,这也是此前我国药品生产的主要模式;而分段生产允许药品生产工序的不同环节在不同生产场地分段完成,例如,根据生物制剂或其他创新药的生产工艺、设施设备需要,将原液生产和制剂灌装委托不同的生产厂家进行生产。
分段生产的实施将为创新药企业带来以下优势:
- 满足特殊、复杂药品的生产需求,解决全部工艺无法由单一受托方完成的问题;
- 优化资源配置,避免产能的重复建设;
- 促进专业化分工(如专注原液或制剂),上市许可持有人可以根据需要将不同的工序委托更专业的生产场地完成;以及
- 提升药品的生产效率,在临床急需的情况下可由多家企业共同协作,加速药品供应。
但是,委托分段生产在实践中的适用也为监管带来挑战,例如监管的重点需要从场地资质转向药品质量管控、跨省或跨境的监管协同难度大等。因此,目前新《条例》要求上市许可持有人首先要作为第一责任人,保证药品生产全过程持续符合法定要求,建立覆盖药品生产全过程和全部生产场地的统一质量保证体系。对于未来需要进行委托分段生产的企业,建议在实践操作中持续关注后续的配套规章、政策,或者地方药监部门的指导性文件等,并积极与监管部门沟通,确保实施过程满足相关合规要求。
2. 商业规模批次药品有条件上市根据《药品生产监督管理办法》第五十二条,通过相应上市前的药品生产质量管理规范符合性检查的商业规模批次,在取得药品注册证书后,符合产品放行要求的可以上市销售。
本次新《条例》的修订,不仅将上市销售符合要求的商业规模批次药品在行政法规层面予以确认,更在《药品生产监督管理办法》第五十二条的基础上,进一步为“新药、罕见病治疗用药品、短缺药品以及其他临床急需的药品”提供了上市销售的绿灯。
根据新《条例》第三十六条,取得药品批准证明文件前生产的下列药品,符合上市放行要求的,在取得批准证明文件后可以上市销售:(1)通过相应药品生产质量管理规范符合性检查的商业规模批次产品;(2)属于新药、罕见病治疗用药品、短缺药品以及其他临床急需的药品的,在通过相应药品生产质量管理规范符合性检查之后生产的商业规模批次产品。
新《条例》第三十六条为临床急需药品(包括新药、罕见病治疗用药品、短缺药品等)在通过药品生产质量管理规范符合性检查后生产的商业规模批次产品上市销售,提供了明确的法律依据,为该等临床急需药品的加速供应提供了便利,缩短了患者用药的等待时间。但同时《条例》第三十六条也要求药品上市许可持有人应当加强对药品获批前的商业规模批次药品上市销售的风险管理。
3. 中药生产(1)中药饮片与中药配方颗粒生产企业履行上市许可持有人义务
《药品管理法》第三十九条规定,中药饮片生产企业履行药品上市许可持有人的相关义务;本次新《条例》第二十九条延续了《药品管理法》的规定,并进一步明确:中药饮片生产企业、中药配方颗粒生产企业履行药品上市许可持有人的相关义务,对生产、销售实行全过程管理,建立追溯体系。
新《条例》将中药配方颗粒生产企业纳入规定是由于原《中药配方颗粒管理暂行规定》曾规定中药配方颗粒原本纳入中药饮片管理范畴,而国家药监局、国家中医药局、国家卫生健康委、国家医保局于2021年联合发布的《关于结束中药配方颗粒试点工作的公告》结束了中药配方颗粒试点工作,并废止了《关于印发〈中药配方颗粒管理暂行规定〉的通知》(国药监注〔2001〕325号)。因此,新《条例》将中药配方颗粒与中药饮片并列,以确保其范围与《药品管理法》中的要求一致。
新《条例》的规定维持了将中药饮片、中药配方颗粒纳入上市许可持有人的监管框架。
(2)中药饮片与中药配方颗粒的生产与销售
新《条例》对中药饮片、中药配方颗粒的生产作出了严格的规定。
《药品管理法》虽要求中药饮片生产企业履行药品上市许可持有人的相关义务,但未对中药饮片、中药配方颗粒的委托生产作出禁止;2021年实施的《关于结束中药配方颗粒试点工作的公告》要求“中药配方颗粒的中药生产企业应当取得《药品生产许可证》,并同时具有中药饮片和颗粒剂生产范围”,且要求“生产企业应当自行炮制用于中药配方颗粒生产的中药饮片”,但未进一步明确委托生产的问题;2022年4月24日,国家药监局召开药品安全专项整治中药相关工作推进会,会上首次提出:“督促生产企业对中药饮片实行全过程管理,不得委托生产”[6]。
新《条例》的本次修订不仅直接明确禁止中药饮片、中药配方颗粒委托生产,还将《关于结束中药配方颗粒试点工作的公告》等规章、政策文件中的部分规定提升至行政法规层级并进一步细化。新《条例》第三十九条和第四十条对中药饮片和中药配方颗粒作出如下规定:

中药饮片、中药配方颗粒应当按照国家药品标准炮制、生产;国家药品标准没有规定的,应当按照省级人民政府药品监督管理部门制定的规范炮制、生产。按照省级人民政府药品监督管理部门制定的规范炮制、生产的中药饮片、中药配方颗粒可以跨省级行政区域销售、使用,但应符合以下要求:
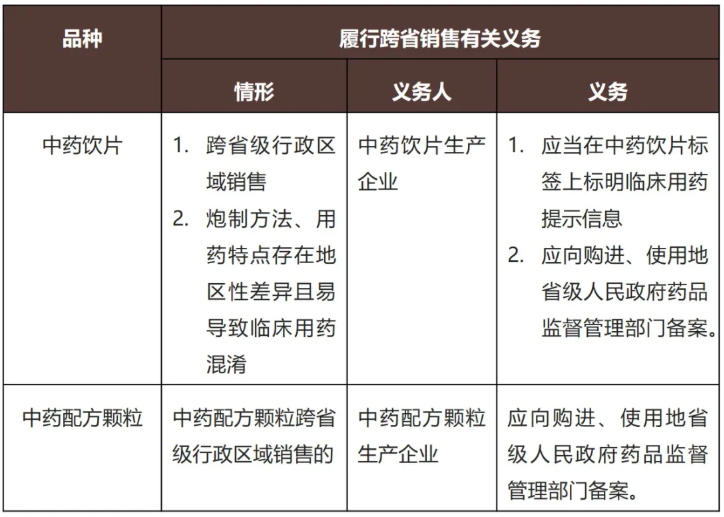
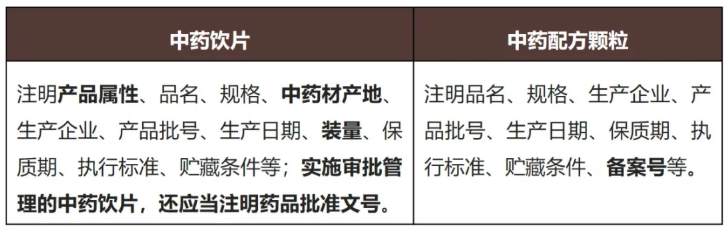
新《条例》对于中药饮片、中药配方颗粒的标签要求如下
此外,新《条例》第三十七条规定,国家鼓励发展中药材规范化种植养殖,鼓励使用道地中药材。根据中药材特点,产地加工被允许,但仍需符合中药材产地加工指导原则(如有)。
新《条例》的上述规定将与国家药监局于2025年8月25日发布、将于2026年3月1日实施的《中药生产监督管理专门规定》形成配套,共同构建中药全链条监管体系。
四、药品的经营与使用新《条例》第五章“药品经营”(第四十二条至第四十八条)、第六章“医疗机构药事管理”(第四十九条至第六十二条),重点聚焦对药品上市后经营、使用的监管。新《条例》从以下几个方面完善了相关制度:一是完善药品网络销售管理制度,明确药品网络交易第三方平台提供者责任,以及网络销售的药品范围;二是加强医疗机构药事管理,保障使用环节药品质量,防控风险;三是细化医疗机构制剂管理制度,明确医疗机构配制制剂审批流程,规定医疗机构制剂调剂使用条件和程序;支持配制儿童用医疗机构制剂,满足儿童患者用药需求[7]。
1. 明确网络销售第三方平台责任现行《条例》第十九条仅规定了通过互联网进行药品交易的主体(药品生产企业、药品经营企业、医疗机构)的相关责任,未明确相关网络平台的责任;而新《条例》着重强调了网络交易平台的管理责任,要求药品网络交易第三方平台提供者建立健全药品网络销售质量管理体系,做好入驻审核、检查监控等工作,相关新旧法规对比如下:

此外,新《条例》第四十六条确立了网络销售负面清单制度:疫苗、血液制品、麻醉药品、精神药品、医疗用毒性药品、放射性药品、药品类易制毒化学品等特殊管理药品不得通过网络销售;其他用药风险较高的药品不得通过网络零售,具体目录由国务院药监部门制定(建议相关药品经营企业、网络平台密切关注国家药监局后续发布的相关目录)。
2. 医疗机构制剂管理细化《药品管理法》第七十四条规定,医疗机构配制制剂,应当经所在地省、自治区、直辖市人民政府药品监督管理部门批准,取得医疗机构制剂许可证。无医疗机构制剂许可证的,不得配制制剂。医疗机构制剂许可证应当标明有效期,到期重新审查发证。新《条例》第五十四条在此基础上进一步明确细化医疗机构制剂注册证书有效期为5年。
同时,根据新《条例》第五十五条,医疗机构还需经审评审批取得医疗机构制剂注册证书(有效期3年)后,方可配制拟配制制剂;但是,仅应用传统工艺配制的中药制剂,无需取得医疗机构制剂注册证书,仅向所在地省级人民政府药品监督管理部门备案后即可配制。
需要注意的是,根据新《条例》第五十七条,以下七类药品不得作为医疗机构制剂:
- 含有尚未用于已注册药品的活性成份的化学药;
- 已注册药品的活性成份用于新适应症的化学药;
- 中药和化学药组成的复方制剂;
- 中药注射剂;
- 医疗用毒性药品;
- 除变态反应原以外的生物制品;
- 国务院药品监督管理部门规定的其他药品。
最后,新《条例》在《药品管理法》的基础上细化了医疗机构制剂的监管要求,有以下内容值得注意:
(a)医疗机构配制制剂,应当遵守医疗机构制剂配制质量管理规范,建立健全制剂配制质量管理体系,保证制剂配制全过程持续符合法定要求。医疗机构的法定代表人、主要负责人对本医疗机构的制剂配制活动全面负责。(新《条例》五十八条)
(b)医疗机构制剂只能凭医师处方在本医疗机构使用,不得在市场上销售或者变相销售,不得发布医疗机构制剂广告。以下情况可以调剂使用(新《条例》第五十九条):
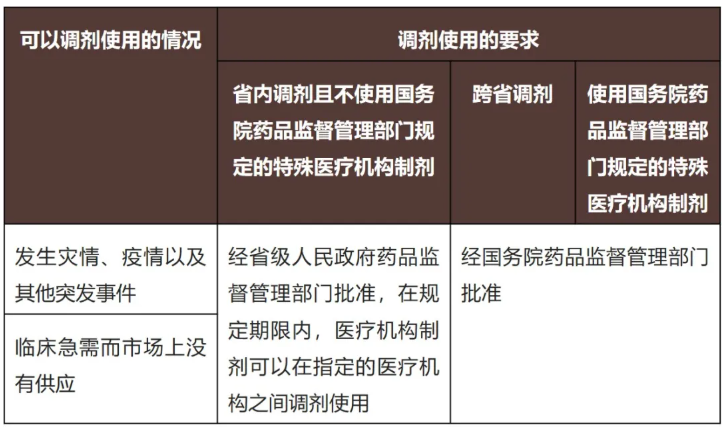
(c)医疗机构发现疑似药品不良反应,应当按照规定及时报告药品监督管理部门和卫生健康主管部门(新《条例》第六十条)。
(d)医疗机构发现购进、使用的药品存在质量问题,应当立即采取措施控制风险,及时告知供货单位和药品上市许可持有人,并向所在地县级人民政府药品监督管理部门报告(新《条例》第六十一条)。
五、药品安全监管与法律责任新《条例》第七章、第八章细化了监管措施和法律责任,对监管部门进行药品质量抽查检验、实施监督检查、假药劣药认定、药品检验、违法处罚等做出了更细致的规定,构建“最严格的监管”制度体系。
1. 监督检查与假药认定新《条例》第六十三条明确药品监管部门可采取现场检查、查封扣押、查阅复制资料等措施,明确了药品安全监督检查措施,也明确有关单位和个人的配合义务。
新《条例》第七十一条细化了《药品管理法》第九十八条第二款第二项“假药”的认定情形;第七十二条对监管部门认定假药与劣药是否需要进行药品检验做出了明确要求。结合《药品管理法》第九十八条、新《条例》第七十一条、第七十二条的内容,我们将假药与劣药的认定总结如下:

*注:除明确规定不需要进行药品检验的情况外,若原料、辅料的采购和使用记录等证据能够充分证明属于假药或者劣药的,可以不进行药品检验。
2. 质量抽查检验、复验新《条例》第六十六条规定药品质量抽查检验应遵循科学、规范、公正原则,细化了药品质量抽查检验的程序,也规定了被抽样单位的配合义务。被抽样单位没有正当理由不予配合的,药品监督管理部门可以责令被抽样单位暂停销售、使用被抽样药品。
此外,新《条例》第六十七条明确当事人对检验结果有异议的,可自收到结果之日起7日内申请复验,这延续了《药品管理法》第一百零二条的规定。但新《条例》在《药品管理法》的基础上进一步细化了复验制度,对复验的费用归属等内容作出了规定。结合《药品管理法》及新《条例》异议及复验的程序总结如下:
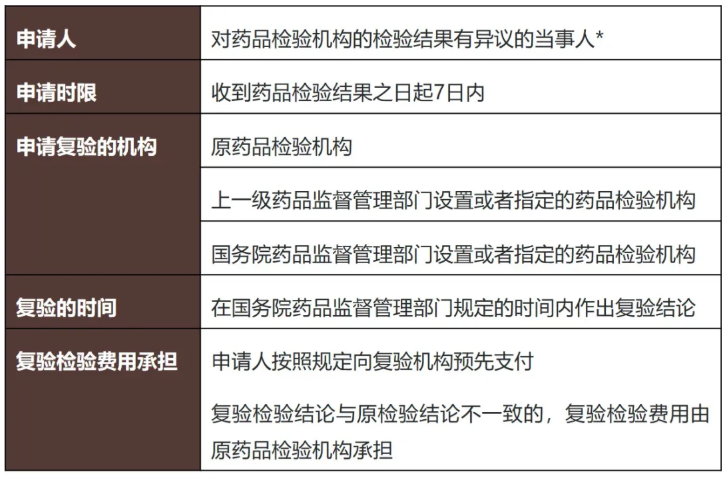
*注:国家药品标准规定不予复验的检验项目,或者有国务院药品监督管理部门规定的其他不予复验的情形的,不予复验。
3. 风险控制措施根据《药品管理法》第九十九条,对有证据证明可能存在安全隐患的,药品监督管理部门根据监督检查情况,应当采取告诫、约谈、限期整改以及暂停生产、销售、使用、进口等措施,并及时公布检查处理结果。
新《条例》第七十条规定了相关企业对上述风险管理措施的配合义务,要求相应的药品上市许可持有人、药品生产企业、药品经营企业、医疗机构应当进行整改,消除安全隐患;且要求相关企业在被省级以上人民政府药品监督管理部门采取暂停生产、销售、使用、进口等风险控制措施的期间,不得发布相关药品的广告。
同时,新《条例》也将相关企业对监管部门采取风险管理措施的配合义务与相关的法律责任做出链接。根据新《条例》第八十五条,若拒不执行药品监督管理部门依法采取的暂停生产、销售、使用、进口等风险控制措施,除了相关企业可能受到违法货值金额5倍以上10倍以下的罚款、被吊销药品批准证明文件、吊销许可证等;相关处罚还涉及个人责任,会对法定代表人、主要负责人、直接负责的主管人员和其他责任人员处2万元以上20万元以下的罚款。
4. 严格的法律责任新《条例》在第八章“法律责任”中,设置了多项严格的处罚措施。例如,做出以下违反新《条例》的行为,违规企业除被责令限期改正,没收违法所得外,还会受到违法生产、销售的药品货值金额10倍以上20倍以下的罚款(违法生产、批发的药品货值金额不足10万元的,按10万元计算,违法零售的药品货值金额不足1万元的,按1万元计算);情节严重的,还会被责令停产停业整顿、吊销药品生产许可证或药品经营许可证:
- 药品上市许可持有人违反新《条例》第三十六条[8]规定销售取得药品批准证明文件前生产的商业规模批次产品;
- 中药饮片生产企业委托炮制中药饮片或者中药配方颗粒生产企业委托生产中药配方颗粒;
- 药品经营企业经营中药配方颗粒、医疗机构制剂;
- 新《条例》第四十六条[9]规定通过网络销售药品。
总体来看,新《条例》在鼓励创新的同时强化了合规与监管要求、加大了处罚力度。一方面,对创新企业而言,从新《条例》中可以获得大量制度倾斜:多项为创新药品开辟的加速上市审评审批程序;境外数据认可机制促进全球创新药品的中国同步上市;市场独占期与数据保护期机制的落地与细化保护创新企业的市场权利;分段生产模式为创新药品生产工艺流程提供更多可能性;允许符合条件的商业批次药品上市销售加速药物供应。与此同时,对医药企业而言,新《条例》的实施将带来更高标准的合规要求:强调上市许可持有人须构建覆盖药品全链条、全周期的管理体系;中药饮片和配方颗粒生产企业被明确禁止委托生产;药品网络交易第三方平台须履行严格的审核责任等。未来,新《条例》将与其他配套法规协同发力,共同回应现阶段医药领域的监管需求,有力助推行业高质量发展。
面对新《条例》此次全面修订,本文仅聚焦了部分修订重点进行整理,希望为企业、医疗机构理解相关法规提供参考。最后需要提醒企业、医疗机构的是,新《条例》将于2026年5月15日正式施行,目前距离施行日仅剩三个多月,应尽快根据新《条例》:修订和完善现有的内部合规体系、质量管理体系、药物警戒体系及药品追溯体系等工作;梳理检查现有的委托生产协议;自查网络销售业务合规风险;做好员工合规培训。如实际操作过程中遇到困难,应积极与监管机构进行沟通协调,按照监管部门的指导完成新《条例》在企业内部的落地,避免新《条例》实施后的合规风险。



